|
Учёные XIX в., опиравшиеся только на теорию химического строения А. М. Бутлерова, не смогли решить все
загадки молекулы бензола и чётко определить понятие ароматичности. Тогда
ароматическим считалось любое органическое вещество, в молекуле которого
содержится бензольное ядро. Но уже в начале XX столетия были открыты небензоидные
соединения, по свойствам, весьма похожие на бензол и его производные, но не
содержащие в своих молекулах бензольного цикла. Этих веществ становилось всё
больше, вот почему теория органической химии остро нуждалась в чётких критериях
ароматичности того или иного соединения.
Бензол Тиле.
Уже Кекуле, обобщив свойства бензола и родственных ему
веществ, ввёл первый критерий — химический: ароматические соединения легко
образуются в самых разных реакциях и устойчивы к действию окислителей. Кроме
того, реакции присоединения по кратным связям у них протекают с трудом, а
замещение атомов водорода в циклах на другие атомы или функциональные группы
происходит легко.
Следующим шагом к утверждению понятия «ароматичность»
стало введение структурного критерия принадлежности вещества к благородному
семейству. Учёные установили, что циклическую молекулу можно считать
ароматической, если она плоская, а длины всех углерод-углеродных связей в
кольце равны и находятся в диапазоне от 0,136 до 0,143 нм (1 нм=10-9м).
Обнаружили и ещё один важный признак ароматических соединений: при замыкании в
цикл энергия линейной молекулы с сопряжёнными двойными связями уменьшается.
Процесс сопровождается выделением тепла и стабилизацией молекулы:
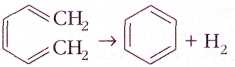
Изучая реакции гидрирования бензола и циклогексена,
учёные обнаружили, что бензол даже более стабилен, чем это предполагал Кекуле.
Так, при гидрировании циклогексена (одна двойная связь в цикле) в циклогексан выделяется
119,7 кДж/моль тепла.
Логично было бы предположить, что при гидрировании
самого бензола, считая, что он содержит три двойные связи, должно выделиться
119,7•3=359,1 кДж/моль тепла. Однако в действительности выделяется на 150,7
кДж/моль меньше. Разницу между расчётным и экспериментальным значениями
энергии назвали энергией стабилизации молекулы бензола.
Дальнейшее развитие структурной теории привело к
созданию нового раздела — квантовой химии и возникновению учения об электронном
строении молекул. В 1931 г. немецкий физик и химик-теоретик Эрих Хюккель
(1896—1980) опубликовал работу, в которой обобщил все накопленные к тому
времени теоретические представления об ароматичности. Именно здесь было
сформулировано квантово-химическое правило, получившее впоследствии имя
исследователя: ароматической является только плоская циклическая молекула,
содержащая делокализованную (равномерно распределённую по циклу) систему p-электронов,
которых должно быть (4n+2), где n=0, 1, 2, 3, ...
Введённые Э. Хюккелем критерии основывались на
квантово-химических расчётах для молекулы бензола как символа ароматичности.
Таким образом была строго обоснована связь ароматичности бензола с наличием в
его молекуле замкнутой системы из шести p-электронов
(n=1). Стало очевидным, что из всех графических формул
бензола наиболее правильной можно считать формулу Кекуле. Однако, как
оказалось, в молекуле ароматического «патриарха» нет меняющихся местами
(осциллирующих) двойных и одинарных связей, а есть шестиатомный углеродный
каркас из одинарных связей, дополнительно укреплённый общей для всей молекулы
системой p-связей.
При этом все углерод-углеродные связи по длине одинаковы, а кратность каждой
из них равна 1,5.
Дальнейшее развитие квантовой химии и электронных представлений
о строении молекул органических веществ привело к разработке теории
гибридизации. В рамках этого учения загадочная молекула бензола оказалась
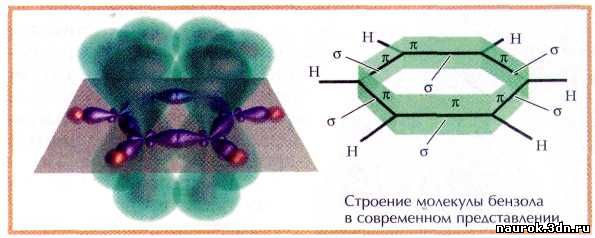
элегантной конструкцией, состоящей из двух электронных систем — s- и p-связей.
Атомы углерода в молекуле бензола находятся в sр2-гибридном состоянии, образуя три
гибридных облака, посредством которых они соединены между собой и с атомами
водорода одинарными связями.
Так образуется p-система, составляющая углеродный
остов молекулы. Перпендикулярно плоскости цикла у каждого из атомов находится
четвёртое негибридизованное р-облако.
Перекрываясь, все эти облака образуют ажурную p-систему,
пронизывающую бензольный цикл насквозь.
А сама молекула бензола очень напоминает бутерброд.
Электронное изображение ароматического кольца даёт исчерпывающие объяснения
всех необычных свойств бензола.
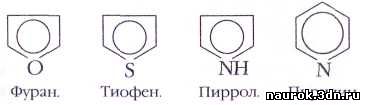
Теория Хюккеля позволила также предсказать ароматичность
веществ, по строению совсем не похожих на бензол, — так называемых небензоидных
соединений. В 1934 г. Хюккель применил своё правило к пяти- и шестичленным
гетероциклам — фурану, тиофену, пирролу и пиридину, об ароматическом характере
которых было известно давно. Выяснилось, что в молекулах этих веществ, как и у
бензола, есть замкнутая p-система
из шести электронов. В пятичленных циклах в её образовании участвует
неподелённая электронная пара гетероатома (кислород, азот, сера), а в
шестичленных такая пара не входит в p-систему. Все эти гетероциклы представляют
собой изоэлектронные аналоги бензола.
Правило Хюккеля не только служит своего рода
индикатором на ароматичность, но и позволяет объяснить ароматический характер
таких необычных углеводородов, как азулен и 10-аннулен:
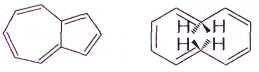
Их плоские циклические молекулы содержат p-системы
с 10 электронами, что полностью соответствует квантово-химическому правилу и
формуле (4n+2), при n=2.
Так дар теоретического предвидения Кекуле, многолетний
труд исследователей, изучавших ароматические вещества, и скрупулёзные
квантовохимические расчёты Хюккеля позволили не только постичь тайну строения
молекулы бензола, но и утвердить понятие ароматичности, расширив его
применительно ко всем циклическим структурам.
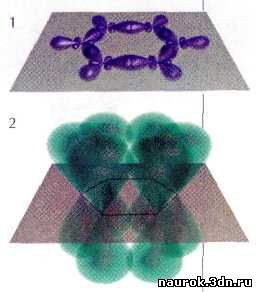
Система s-связей
(1) и p-связей
(2) бензола.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К