|
В
начале 50-х гг. XX в. американские
химики Лайнус Карл Полинг (1901 — 1994), награждённый Нобелевской премией за
исследования природы химической связи, и Роберт Кори (1897—1971)
предположили, что некоторые участки аминокислотной цепочки в белках закручены
в спираль. Благодаря совершенствованию экспериментальных методов (структуру
белков изучают с помощью рентгеновских лучей) через несколько лет эта
гениальная догадка подтвердилась.
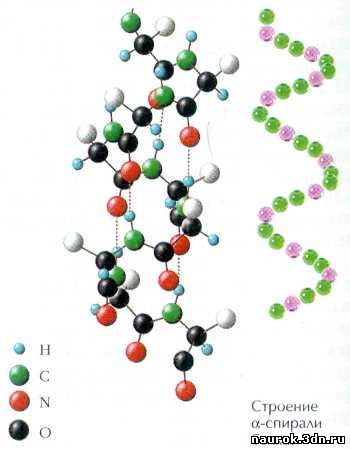
Действительно,
полипептидные цепи очень часто образуют спираль, закрученную в правую сторону.
Это первый, самый низкий уровень пространственной организации белковых
цепочек. Здесь-то и начинают играть роль слабые взаимодействия
«бусинок»-аминокислот: группа С=О и группа N—Н из разных пептидных связей могут образовывать между
собой водородную связь. Оказалось, что в открытой Полингом и Кори спирали
такая связь образована между группой С=О каждой i-й аминокислоты
и группой N—Н (i+4)-й аминокислоты, т. е. между собой связаны
аминокислотные остатки, отстоящие друг от друга на четыре «бусинки». Эти
водородные связи и стабилизируют такую спираль в целом. Она получила название
a-спирали.
Позднее
выяснялось, что a-спираль
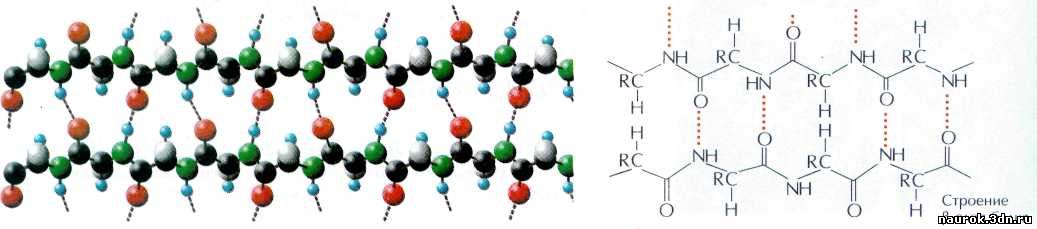
— не единственный способ укладки аминокислотных цепочек. Помимо спиралей они
образуют ещё и слои. Благодаря всё тем же водородным связям между группами С=О
и N—Н друг с другом могут «слипаться»
сразу несколько разных фрагментов одной полипептидной цепи. В результате
получается целый слой — его назвали b-слоем.
В
большинстве белков a-спирали
и b-слои
перемежаются всевозможными изгибами и фрагментами цепи без какой-либо определённой
структуры. Когда имеют дело с пространственной структурой отдельных участков
белка, говорят о вторичной структуре белковой
молекулы.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К