|
Сероводород H2S — бесцветный газ (tпл=-86 °С, tкип=-60
°С) с характерным резким запахом тухлых яиц (строго говоря, не сероводород
пахнет тухлыми яйцами, а тухлые яйца пахнут сероводородом, который выделяется
при разложении серосодержащих белков), немного тяжелее воздуха, малорастворимый
в воде. При 20 °С в 100 мл воды растворяется 2,6 мл H2S.
Сероводород необычайно ядовит: отравление возникает уже при его концентрации
в воздухе около 200 мг/м3, а даже один вдох чистого H2S смертелен! Опасность усугубляется тем,
что при концентрациях более 225 мг/м3 человек перестаёт ощущать
запах сероводорода из-за паралича органов обоняния. При отравлении
пострадавшего необходимо немедленно вывести на свежий воздух и вызвать врача.
Сероводород встречается в природе, как правило, над
нефтью или в виде примеси к природному газу. Им могут быть заполнены пещеры,
гроты. Небольшое количество этого газа в растворённом виде содержится в воде
серных источников. Наиболее известные из них — курорт Мацеста вблизи города
Сочи, а также Кавказские Минеральные Воды. Значительные количества H2S выделяются в атмосферу в результате
вулканической деятельности.
В лаборатории сероводород получают действием
разбавленной (20 %) серной кислоты на сульфид железа: FeS+H2SO4=FeSO4+H2S.
Удобным методом получения сероводорода служит нагревание смеси серы с
парафином.
При горении H2S на воздухе образуется сернистый газ:
2H2S+3О2= 2SO2+2H2O. Если в пламя горящего сероводорода внести холодный
предмет, например фарфоровую чашку, то она покроется тонким налётом серы —
продукта неполного окисления
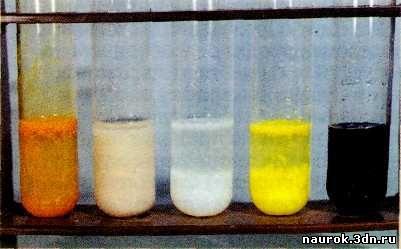
При взаимодействии сероводорода или раствора сульфида
натрия с солями металлов образуются осадки сульфидов. Многие из них имеют
характерную яркую окраску. Эта особенность используется в химическом анализе.
Например, сульфиды меди, свинца и железа окрашены в чёрный цвет, кадмия — в
жёлтый, сурьмы — в оранжевый, марганца — в бледно-розовый, а цинка — в белый.
На фото — осадки Sb2S3, MnS, ZnS, CdS, FeS.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К