|
Озон O3 (от греч. «озон» — «пахнущий») —
неустойчивый газ голубого цвета с резким «металлическим запахом» (Д. И.
Менделеев сравнивал его с запахом раков), в полтора раза тяжелее воздуха. Озон
растворим в воде примерно в 10 раз лучше, чем кислород (49,4 мл в 100 мл воды
при 0 °С). При температуре -112 °С озон конденсируется в тёмно-синюю жидкость,
а при -193 °С кристаллизуется. Твёрдый озон представляет собой сине-фиолетовые
кристаллы.
В природе озон образуется в верхних слоях атмосферы (на
высоте 20— 30 км) из кислорода под действием ультрафиолетового излучения
Солнца, а кроме того, при сварке, при работе электрических трансформаторов, ксероксов,
при ударе молнии. Озон сильно ядовит. Предельно допустимая его концентрация в
воздухе составляет 0,1 мкг/л, а это означает, что озон намного опаснее хлора!
Польза от вдыхания малых количеств озона — миф. Приятное ощущение свежести в
лесу после грозы создаёт не сам озон, а продукты окисления им смолы и эфирных
масел, содержащихся в хвое.
В лаборатории озон получают в озонаторах действием на
кислород тихого электрического разряда (кислород на выходе из озонатора
содержит около 5% озона): 3О2«2О3
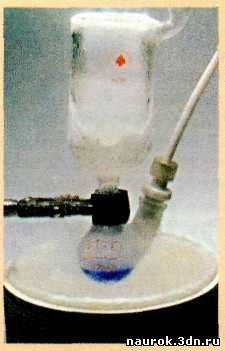
Жидкий озон имеет цвет индиго.
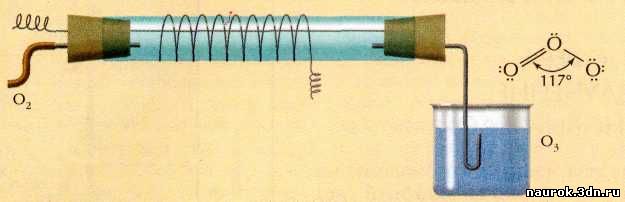
Строение простейшего озонатора. Внутрь широкой
стеклянной трубки вставлена проволока. Снаружи трубка обмотана другой
проволокой. Если к концам двух проволок приложить напряжение в несколько тысяч
вольт, а через трубку пропускать кислород, то выходящий из неё газ будет
содержать несколько процентов озона.
Запах озона легко уловить при внесении порошка
пероксида бария в охлаждённую серную кислоту, а также при растирании в ступке
кристаллов перманганата калия.
Озон — значительно более сильный окислитель, чем
кислород. Так, он легко окисляет водный раствор иодида калия: 2KI+О3+Н2О=2КОН+I2+О2 (качественная реакция
на озон).
При пропускании озона через охлаждённый
концентрированный раствор гидроксида калия возникает красное окрашивание, а
затем выпадает осадок озонида калия красного цвета: 2КОН+5О3=2KO3¯+5О2+Н2О.
Озон окисляет органические соединения, расщепляя
кратные связи углерод-углерод (это используется в органическом анализе).
Однако главное применение озона — обеззараживание водопроводной воды. Озон,
растворённый в воде, быстро распадается с образованием безвредного кислорода.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К