|
Для правильной работы систем клетки необходима их
чёткая организация. Поэтому природа придумала хитрый механизм, который позволяет
управлять процессом группировки молекул.
Обычные ковалентные связи для объединения макромолекул
не подходят, ведь атомы, связанные ковалентной связью, становятся частями
одной молекулы. Если представить организацию макромолекул в клетке с помощью
ковалентных связей, получится, что клетка — одна гигантская макромолекула!
Кроме того, ковалентные связи слишком прочны — настоящий «стальной трос». Для
огромных неповоротливых громадин вроде белков или нуклеиновых кислот нужно
нечто совсем иное — подобие тонкой рыболовной сети. Такая «сеть» надёжно
удержит молекулы вместе и одновременно предоставит им некоторую свободу,
необходимую для выполнения их функции.
Сеть, объединяющая две макромолекулы, образуется
потому, что ковалентно связанные атомы способны взаимодействовать с
близлежащими атомами в пределах одной и той же либо разных молекул. Эти
взаимодействия значительно слабее, чем ковалентные связи, и название у них
соответствующее — слабые взаимодействия.
В биомолекулах различают три типа слабых взаимодействий — водородные связи, ионные взаимодействия и
вандерваальсовы силы (см. статью
«Химическая связь»).
Ещё одно важное слабое взаимодействие обусловлено не
столько природой сближенных атомов, сколько пространственной структурой воды.
У этого уникального вещества слишком упорядоченная для жидкости структура,
поддерживаемая водородными связями. Когда в такую отлаженную систему
внедряются чужеродные объекты — неполярные группы атомов, которые в изобилии
содержатся во многих биомолекулах, водородные связи нарушаются. Это крайне
невыгодно с термодинамической точки зрения. Чтобы избежать значительного
проигрыша в энергии, остаётся один выход — собрать чужеродные неполярные
остатки в одну кучку и уменьшить таким образом их соприкосновение с молекулами
воды. В итоге получается, что неполярные остатки, попадая в воду, стремятся
держаться вместе и образуют контакты друг с другом, а не с молекулами воды.
Эти контакты называются гидрофобными (от
греч. «гидор» — «вода» и «фобос» —
«страх») взаимодействиями.
Слабые взаимодействия вопреки своему названию наделены
сильной властью. Они определяют, как различные участки молекул располагаются
друг относительно друга. В результате слабых взаимодействий за счёт участия в
них огромного количества атомов формируются устойчивые структуры. Одну или две
связи, конечно, легко разорвать, но с возникновением множества связей
прочность взаимодействия существенно повышается.
Большое число контактов между атомами взаимодействующих
молекул определяется тем, что их поверхности соответствуют друг другу. Конечно,
когда речь идёт о маленьких молекулах, например о молекуле воды, слово
«поверхность» не совсем уместно. Но на уровне макромолекулы поверхность
становится важнейшим понятием. Все крупные молекулы свёрнуты в пространстве
так, что часть групп остаётся снаружи, а часть «смотрит внутрь». От того, какие
группы находятся на поверхности, очень сильно зависят свойства всей макромолекулы.
Чтобы взаимодействие двух макромолекул было прочным, их
поверхности должны быть, как говорят учёные, комплементарны (от лат. complementum —
«дополнение»). Предположим, что на поверхности одной молекулы имеется выступ,
например метильная группа СН3. Тогда взаимодействующая с ней
молекула должна иметь соответствующее углубление на своей поверхности. Если поверхность
одной молекулы заряжена положительно, то на поверхности другой должен быть
отрицательный заряд. Таким образом, две молекулы с комплементарными
поверхностями стремятся к взаимодейсгвию, в то время как молекулы, не
содержащие комплементарных поверхностей, не образуют контактов. Выдающийся
учёный Джеймс Дьюи Уотсон (родился в 1928 г.), лауреат Нобелевской премии,
один из авторов самого важного открытия в молекулярной биологии —
пространственной структуры ДНК, назвал это явление принципом избирательной
«слипаемости» молекул. В научной литературе более распространено другое
название — принцип структурной
комплементарности. Это важнейший принцип, которому подчиняются все
взаимодействия в клетке. Он лежит в основе самосборки многих структур клетки.
Итак, макромолекулы с подходящими «формами» распознают
друг друга и стремятся к объединению. Например, молекулы белков и липидов
могут ассоциировать, образуя липопротеиды.
Эти комплексы присутствуют в плазме крови млекопитающих и выполняют
транспортные функции — осуществляют перенос веществ в организме. При объединении
нуклеиновых кислот и белков в комплекс образуются сложные по строению нуклеопротеиды (от лат. nucleus —
«ядро»), выполняющие различные биологические функции. Один из их наиболее
широко распространённых классов — вирусы.
Есть среди нуклеопротеидов и такие, без которых трудно
представить живую клетку. Это рибосомы — комплексы,
состоящие приблизительно из 55—100 различных белковых молекул и нескольких
молекул РНК (см. статью «Экспрессия генов»). Рибосомы играют важнейшую роль —
на них происходит сборка новых белков в клетке. Это уникальное изобретение
природы, основной атрибут жизни. Ведь жизнь начинается там, где кипит синтез
белка!
Комплексы макромолекул — далеко не последний уровень
организации клетки. Они объединяются в отдельные структуры — клеточные органеллы: ядра, митохондрии,
хлоропласты и т. п. Различные компоненты клеточных органелл также объединяются
друг с другом в основном при помощи нековалентных взаимодействий
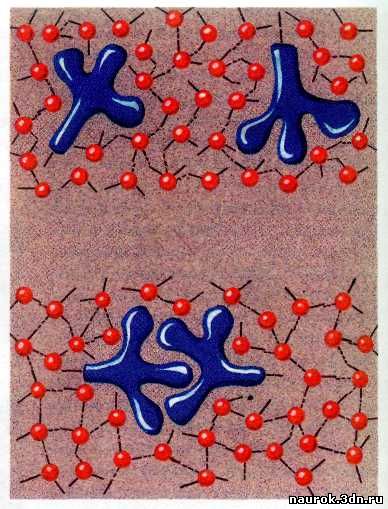
Гидрофобные взаимодействия.

Строение липидного бислоя. Липиды прячут свои неполярные
«хвосты» (радикалы жирных кислот), в результате чего и образуется бислой.

Несмотря на своё название, слабые взаимодействия играют
очень важную роль в биохимии.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К