|
Одни из самых распространённых комплексов металлов —
карбонилы. Если в комплексе один атом металла, его называют моноядерным. Например,
карбонил железа Fe(CO)5, карбонил никеля Ni(CO)4
и т. п. При облучении Fe(CO)5 ультрафиолетовым светом
образуется биядерный комплекс Fe2(CO)9, затем триядерный Fe3(CO)12 и т. д. При конденсации карбонилов могут
образовываться сложные структуры, содержащие остов из многих атомов металла — Rh6(CO)l6, Os20(CO)2-40 и т. п. Это похоже на «гроздь»
связанных друг с другом атомов металлов. Отсюда и название — кластер (англ cluster — «гроздь»). Важнейшая отличительная
особенность кластерных — присутствие в них химически связанных друг с другом
атомов металлов.
Карбонильную группу в кластерах можно заменить на
другие лиганды, например на трифенилфосфин Р(СбН5)3.
Да и металлы в одном кластерном ядре могут быть разными —например, железо с
медью или кадмием; хром, марганец и вольфрам.
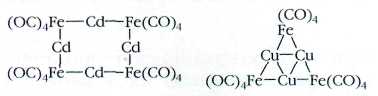
Часто металлический остов представляет собой некий
замкнутый объём — куб, бипирамиду, октаэдр. Один из атомов может оказаться
внутри этого объёма. Свойства такого «узника» коренным образом меняются.
Например, в карбидном кластере железа внутренний атом углерода связан со всеми
шестью атомами металла одновременно.
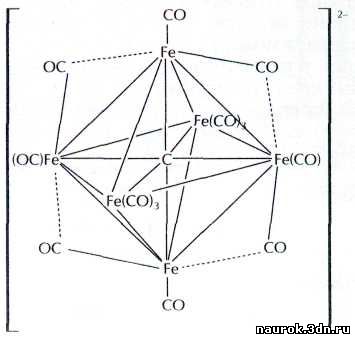
Добраться до этого атома углерода можно, только
разрушив кластерное ядро, поэтому обнаружить его присутствие удалось лишь с
помощью рентгеноструктурного анализа.
Элементоорганическая химия — пожалуй, единственная
область экспериментальной химии, которая сама, практически полностью, создала
свой предмет исследований (пока известно всего лишь одно природное соединение,
содержащее прямую связь углерод-металл, — одна из форм витамина В12).
Реактивы Гриньяра — магнийорганические соединения, например, стали обыденным
инструментом химика, а многие другие металлоорганические соединения —
промышленными катализаторами.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К