|
В
каждой молекуле аминокислоты есть атом углерода, связанный с четырьмя
заместителями. Один из них — атом водорода, второй — карбоксильная группа
—СООН. Она легко «отпускает на волю» ион водорода Н+, благодаря
чему в названии аминокислот и присутствует слово «кислота». Третий заместитель
— аминогруппа —NH2, и,
наконец, четвёртый заместитель — группа атомов, которую в общем случае
обозначают R. У всех аминокислот R-группы разные, и каждая из них играет свою, очень
важную роль.
Свойства
«бусинок», отличающие одну аминокислоту от другой, скрыты в R-группах (их ещё называют боковыми цепями). Что же
касается группы —СООН, то химики-органики относятся к ней с большим почтением:
всем другим атомам углерода в молекуле даются обозначения в зависимости от
степени их удалённости от карбоксильной группы. Ближайший к ней атом именуют a-атомом,
второй — b-атомом,
следующий — g-атомом
и т. д. Атом углерода в аминокислотах, который находится ближе всех к
карбоксильной группе, т. е. a-атом,
связан также с аминогруппой, поэтому природные аминокислоты, входящие в
состав белка, называют a-аминокислотами.
В
природе встречаются также аминокислоты, в которых NH2-группа связана с более отдалёнными от карбоксильной
группы атомами углерода. Однако для построения белков природа выбрала именно a-аминокислоты.
Это обусловлено прежде всего тем, что только a-аминокислоты,
соединённые в длинные цепи, способны обеспечить достаточную прочность и
устойчивость структуры больших белковых молекул.
Число a-аминокислот,
различающихся R-группой, велико. Но чаще других в
белках встречается всего 20 разных аминокислот. Их можно рассматривать как
алфавит «языка» белковой молекулы. Химики называют эти главные аминокислоты
стандартными, основными или нормальными. Условно основные аминокислоты делят
на четыре класса.
В
первый входят аминокислоты с неполярными боковыми цепями. Во второй —
аминокислоты, содержащие полярную группу. Следующие два составляют
аминокислоты с боковыми цепями, которые могут заряжаться положительно (они объединяются
в третий класс) или отрицательно (четвёртый). Например, диссоциация
карбоксильной группы даёт анион — СОО-, а протонирование атома
азота — катион, например —NH3+.
Боковые цепи аспарагиновой и глутаминовой кислот имеют ещё по одной карбоксильной
группе —СООН, которая при значениях рН, характерных для живой клетки (рН»7), расстаётся с ионом водорода (Н+)
и приобретает отрицательный заряд. Боковые цепи аминокислот лизина, аргинина
и гистидина заряжены положительно, поскольку у них есть атомы азота, которые,
наоборот, могут ион водорода присоединять.
Каждая a-аминокислота
(кроме глицина) в зависимости от взаимного расположения четырёх заместителей
может существовать в двух формах. Они отличаются друг от друга, как предмет от
своего зеркального отражения или как правая рука от левой. Такие соединения
получили название хиральных (от греч. «хир» — «рука»). Хиральные
молекулы открыл в 1848 г. великий французский учёный Луи Пастер. Два типа
оптических изомеров органических молекул получили названия D-форма
(от лат. dexter — «правый») и L-форма
(от лат. laevus — «левый»). Кстати, одно из названий
других хиральных молекул — глюкозы и фруктозы — декстроза и левулоза.
Примечательно, что в состав белков входят только L-аминокислоты,
и вся белковая жизнь на Земле — «левая».
Для
нормальной жизнедеятельности организм нуждается в полном наборе из 20
основных a-L-аминокислот.
Но одни из них могут быть синтезированы в клетках самого организма, а другие —
должны поступать в готовом виде из пищевых продуктов. В первом случае
аминокислоты называют заменимыми, а
во втором — незаменимыми. Набор
последних для разных организмов различен. Например, для белой крысы
незаменимыми являются 10 аминокислот, а для молочнокислых бакгерий — 16. Растения
могут самостоятельно синтезировать самые разнообразные аминокислоты, создавать
такие, которые не встречаются в белках.
Для
удобства 20 главных аминокислот обозначают символами, используя одну или
первые три буквы русского или английского названия аминокислоты, например аланин
— Ала или А, глицин — Гли или G.
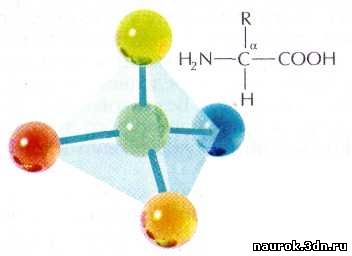
Структурная
формула a-аминокислоты.
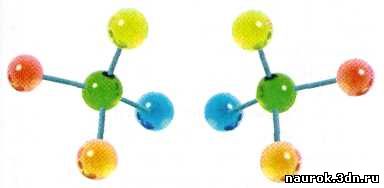
Оптические
изомеры a-аминокислоты.
Подобно предмету и его отражению в зеркале, оптические изомеры не могут быть
совмещены в пространстве.
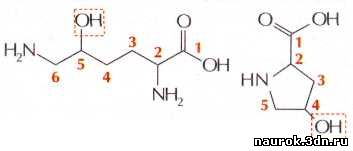
В
некоторых белках содержатся особые аминокислоты, не входящие в число двадцати
стандартных. Они образуются модификацией нормальных аминокислот. Например, в
белке соединительной ткани — коллагене найдены 4-гидроксипролин и
5-гидроксилизин. От пролина и лизина они отличаются только гидроксильной
группой. Эта группа необходима для образования прочных волокон коллагена.
Недостаток такой модификации пролина и лизина в коллагене приводит к развитию
цинги.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К