|
Ежесекундно на Земле вспыхивает в среднем 100 молний. И
хотя каждая вспышка длится всего доли секунды, их общая электрическая мощность
достигает 4 млрд. киловатт. Резкое повышение температуры в канале молнии — до
20 000 °С — приводит к разрушению молекул азота и кислорода с образованием
оксида азота NO. Последний затем окисляется
атмосферным кислородом в диоксид: 2NO+О2=2NO2, который в свою очередь, реагируя при
избытке кислорода с атмосферной влагой, превращается в азотную кислоту: 4NO2+2Н2О+О2=4HNO3. В результате этих процессов
ежедневно образуется примерно 2 млн. тонн HNO3 (или более 700 млн. тонн в год), и в
виде слабого раствора выпадает на землю с дождями. Это количество «небесной»
азотной кислоты интересно сравнить с её промышленным производством, к слову,
одним из самых крупнотоннажных. Оказывается, здесь человек далеко отстаёт от
природы: мировое производство азотной кислоты составляет около 30 млн. тонн в
год.
Благодаря расщеплению молекул азота молниями на каждый
гектар земной поверхности, включая горы и пустыни, моря и океаны, ежегодно
выпадает около 15 кг азотной кислоты. В почве, а частично и в атмосфере, она
переходит в соли — нитраты, которые являются прекрасными азотными удобрениями
и необходимы для роста растений.
Конечно, не одни только молнии «трудятся» над
переработкой атмосферного азота в удобрения. Более того, они — даже не
главный поставщик «связанного азота». Основную работу по так называемой
фиксации азота — переводу его из воздуха в почву — осуществляют разнообразные
бактерии. Например, находящиеся в почве азотобактерии усваивают за год из
воздуха до 50 кг азота на 1 га. Наиболее важные азотфиксирующие бактерии «сожительствуют»
с растениями, в основном с бобовыми — клевером,
горохом, фасолью, люцерной и др. Они «поселяются» на
корнях — в особых клубеньках; часто их так и называют— «клубеньковые
бактерии». Эти труженики связывают в среднем ещё 150 кг азота на 1 га, а в
особо благоприятных условиях — до 500 кг!
Кроме того, земледельцы вносят немалое количество
азотных удобрений — от десятков до сотен килограммов на 1 га пашни ежегодно.
Так что же, «грозовой азот» не так уж и важен? Отнюдь. Азотные удобрения стали
широко использовать только в XIX в. К тому же никто из сельхозработников никогда,
конечно, не «подкармливал» огромные лесные массивы, степи, саванны и другие
участки Земли, покрытые растительностью, — это делала «небесная канцелярия».
Наконец, молнии начали сверкать в атмосфере миллиарды лет назад, задолго до
появления азотфиксирующих бактерий. Вот и получается, что грозы сыграли
немаловажную роль в «связывании» атмосферного азота. По подсчётам учёных,
только за последние два тысячелетия молнии перевели в удобрения 2 трлн. тонн
азота — примерно 0,1 % всего его количества в воздухе.
Но главная роль этих грозовых явлений природы для жизни
на Земле, вероятно, заключалась всё же в другом. В 1945—1958 гг. в Чикагском
университете работал знаменитый физикохимик, лауреат Нобелевской премии (за
открытие тяжёлого водорода — дейтерия) Гарольд Клейтон Юри (1893— 1981). Он
интересовался проблемами химической эволюции на Земле и происхождением жизни.
Вместе со студентом Стэнли Миллером учёный поставил в лаборатории необычный
эксперимент: через смесь метана, аммиака, водорода и водяных паров пропускали
мини-молнии, проще говоря, электрические разряды. Смесь эту Юри рассматривал как
модель ранней земной атмосферы, которую пронизывали молнии многочисленных гроз.
Уже в первых опытах Миллер наблюдал образование в колбе аминокислот — основных
компонентов любых белков, что доказывало возможность их синтеза в первичной
атмосфере.
Суть явления можно объяснить так. Под действием
электрических разрядов в газовой смеси образуется циановодород (синильная
кислота) HCN.
Энергия молний на Земле в древности составляла за год 1,1•1018 Дж, что
было достаточно для возникновения в атмосфере около миллиона тонн HCN ежегодно. Это вещество вымывалось
дождями в океан. Несмотря на простой состав, молекула HCN уникальна: она находится на границе
органической и неорганической природы и вступает в самые разнообразные
химические реакции, в том числе с образованием биомолекул. В этом отношении с
циановодородом не может соперничать ни одно из известных ныне соединений.
Помимо циановодорода под действием электрических
разрядов в исходной газовой смеси появляются и другие соединения, например
формальдегид НСНО. Происходящие между ними химические процессы были изучены задолго
до опытов Юри — Миллера. Ещё в 1850 г. немецкий химик Адольф Фридрих Людвиг
Штреккер (1822— 1871) наблюдал образование a-аминокислот
из альдегидов или кетонов под действием аммиака и синильной кислоты. Например,
из простейшего альдегида — формальдегида в присутствии аммиака, циановодорода
и воды получается простейшая аминокислота — глицин:
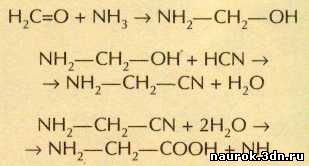
Реакция Штреккера имеет не только теоретическое
значение: она широко используется для лабораторного и промышленного синтеза a-аминокислот.
Так что без преувеличения можно сказать, что вклад
молний в развитие жизни на Земле огромен. Кто знает — может быть, без них жизнь
на нашей планете вообще не возникла бы, либо её разнообразие было бы куда
беднее...
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К