|
Анилин (фениламин, C6H5NH2) — бесцветная ядовитая жидкость с
характерным запахом, малорастворимая в воде (tкип = 184
°С). Так назвал это вещество Ю. Ф. Фрицше, выделивший его в 1840 г. из
продуктов взаимодействия краски индиго со щёлочью (от араб. «ан-нил» — «синяя краска», «индиго»). Анилин — простейший
представитель ароматических аминов. В соединениях этого класса свободная
электронная пара атома азота аминогруппы «затянута» в бензольное ядро. Поэтому
по свойствам анилин заметно отличается и от алифатических аминов, и от
бензола. Так, по сравнению с аммиаком и алкиламинами (например, метиламином CH3NH2), анилин представляет собой гораздо более слабое основание.
Его водные растворы не изменяют окраски лакмуса и фенолфталеина. Однако в
присутствии сильных кислот анилин, как и другие амины, образует соли (например,
хлорид фениламмония [C6H5NH3]+Cl-).
Повышение электронной плотности в 2,4,6-положениях
бензольного ядра приводит к тому, что анилин гораздо легче, чем бензол,
вступает в реакции замещения, типичные для ароматических соединений:
галогенирование, нитрование, сульфирование. Так, при взаимодействии водного
раствора анилина с бромной водой выпадает белый осадок 2,4,6-триброманилина.
При хранении на воздухе анилин окисляется и превращается
в тёмную вязкую жидкость. Качественной реакцией на анилин служит образование
фиолетового окрашивания при окислении хлорной известью — она содержит
гипохлорит кальция.
В промышленных масштабах анилин производят
восстановлением нитробензола водородом. Реакция протекает в газовой фазе в
присутствии катализаторов, содержащих переходные металлы — медь и никель:
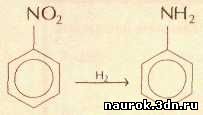
Другим методом получения анилина является аммонолиз
фенола:
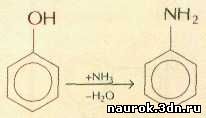
В основном анилин расходуется на производство
красителей.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К