Однако таблице Менделеева предстояла еще одна
серьезная проверка — в ней должно было найтись место для других вновь
открытых элементов.
Например, еще в 1794 г. финский химик Юхан Гадолин
(1760—1852) предположил, что в минерале, полученном из Иттербийского
карьера, расположенного вблизи Стокгольма, содержится новый оксид
металла (или земля). Поскольку эта новая земля значительно
отличалась от уже известных земель, например кремнезема, извести и
магнезии, то ее отнесли к редким землям. Гадолин назвал открытый им
оксид иттрия по названию карьера; спустя 50 лет из этого оксида был
выделен в относительно чистом виде новый элемент — иттрий.
Примерно в середине XIX столетия химики начали интенсивно изучать состав
редкоземельных минералов. Проведенные исследования показали, что эти
минералы содержат целую группу новых элементов — редкоземельных элементов.
Шведский химик Карл Густав Мосандер (1797—1858) открыл, например, в
конце 30-х — начале 40-х годов XIX в. четыре редкоземельных элемента: лантан, эрбий, тербий и дидим.
На самом деле их было пять, поскольку спустя сорок лет в 1885 г.
австрийский химик Карл Ауэр фон Вельсбах (1858—1929) обнаружил, что
дидим представляет собой смесь двух элементов, которые он назвал празеодимом и неодимом. Лекок де Буабодран также открыл два редкоземельных элемента: самарий в 1879 г. и диспрозий в 1886 г. Сразу два редкоземельных элемента — гольмий и тулий
описал в 1879 г. П. Т. Клеве, а в 1907 г. французский химик Жорж Урбэн
(1872—1938) сообщил о новом четырнадцатом редкоземельном элементе — лютеции (Лютеция — древнее название Парижа).
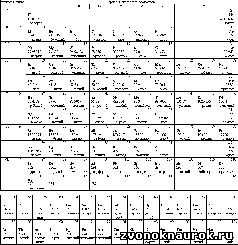
Рис. 18. Современная периодическая таблица элементов.
Редкоземельные элементы обладают очень сходными
химическими свойствами, их валентность равна трем. По-видимому, все эти
элементы необходимо было поместить в один столбец периодической таблицы.
Однако ни один из столбцов не был таким длинным, чтобы вместить
четырнадцать элементов. Далее, поскольку атомные веса всех
редкоземельных элементов очень близки, их следовало поместить в один
горизонтальный ряд, другими словами, в один период. В принципе их можно
было поместить в шестой период, если предположить, что он длиннее, чем
четвертый и пятый, которые в свою очередь длиннее, чем второй и третий
периоды. Однако объяснить причины сходства свойств редкоземельных
элементов в то время не удалось (это было сделано лишь в 20-х годах XX
в., см. гл. 13).
Другая группа вновь открытых элементов, о
существовании которой во времена Менделеева химики и не подозревали, не
вызвала таких затруднений; элементы этой группы прекрасно вписались в
периодическую таблицу.
В 80-х годах прошлого века английский физик Джон
Уильям Стратт, лорд Рэлей (1842—1919), с большой точностью определил
атомные веса кислорода, водорода и азота. При этом он установил, что
атомный вес азота меняется в зависимости от источника газа. Так, атомный
вес азота, полученного перегонкой жидкого воздуха, немного больше, чем у
азота, полученного химическим путем.
Шотландский химик Уильям Рамзай (1852—1916)
заинтересовался этой проблемой и вспомнил об эксперименте Кавендиша (см.
гл. 4), который еще в 1785 г. пытался связать азот воздуха с
кислородом; в свое время эта работа не привлекла внимания химиков.
Кавендиш установил тогда, что последний пузырек газа нельзя было
заставить соединиться с кислородом ни при каких условиях. Логично было
предположить, что этот последний пузырек газа мог быть и не азотом.
Возможно, получаемый из воздуха азот содержит в качестве примеси другой
газ, плотность которого выше, и именно поэтому полученный из воздуха
азот кажется немного тяжелее, чем есть на самом деле.
В 1894 г. Рамзай повторил эксперимент Кавендиша,
выделил оставшийся пузырек газа и провел его анализ новым методом, во
времена Кавендиша еще неизвестным. Рамзай нагрел этот газ, изучил его
спектр. В результате выяснилось, что оставшийся пузырек представляет
собой новый газ, плотность которого несколько выше, чем у азота.
Содержание его в атмосфере равно примерно 1% (по объему). Он химически
инертен, не реагирует ни с одним другим элементом. По этой причине газ
получил название аргон (от греческого άρυός — инертный).
Атомный вес аргона, как выяснилось, чуть меньше 40.
Это означало, что аргон должен располагаться в периодической таблице
где-то возле таких элементов, как сера (атомный вес 32), хлор (атомный
вес 35.5), калий (атомный вес 39) и кальций (атомный вес чуть больше
40).
Исходя только из атомного веса аргона, его следовало
поместить между калием и кальцием. Однако, согласно установленному
Менделеевым принципу, валентность играет более важную роль, чем атомный
вес. Поскольку аргон не взаимодействует ни с одним элементом, то,
следовательно, валентность его равна нулю. Куда в таком случае поместить
аргон?
Валентность серы равна 2, хлора 1, калия 1 и кальция
2. Таким образом, в этой области периодической таблицы валентность
меняется в следующей последовательности: 2, 1, 1, 2. Нуль в такой
последовательности должен располагаться между двумя единицами; 2, 1, 0,
1, 2. Следовательно, место аргона между хлором и калием.
Однако, если принять периодическую таблицу как
руководство, аргон не может существовать один. Он должен быть одним из
представителей семейства инертных газов — элементов с нулевой
валентностью. Столбец, занимаемый этими газами, должен располагаться
между столбцами, занятыми галогенами (хлором, бромом и т. д.) и
щелочными металлами (натрием, калием и т. д.); валентность и тех, и
других равна единице.
Рамзай начал поиски. В 1895 г. он узнал, что в США из
уранового минерала получены пробы газа — предположительно азота. Рамзай
повторил эту работу и установил, что в спектре этого газа содержатся
линии, которых нет ни в спектре азота, ни в спектре аргона, зато такие
же линии наблюдал в солнечном спектре во время солнечного затмения 1868
г. французский астроном Пьер Жюль Сезар Жанссен (1824—1907). В то время
английский астроном Джозеф Норман Локьер (1836—1920) приписал эти линии
новому элементу, который он назвал гелием (от греческого ήλιος — Солнце).
В свое время химики почти не обратили внимания на это
сообщение: новый элемент был открыт на Солнце, да еще довольно новым,
не вполне завоевавшим доверие методом. Однако работа Рамзая показала,
что тот же самый элемент существует и на Земле. Рамзай сохранил за
элементом название, данное ему Локьером. Так был открыт гелий — самый
легкий из инертных газов, который стоит вслед за водородом — элементом с
наименьшим атомным весом.
В 1898 г., осторожно нагревая жидкий воздух в поиске
инертных газов, которые, как предполагал Рамзай, будут испаряться
первыми, он обнаружил три новых газа. Рамзай назвал их неон (новый), криптон (скрытый) и ксенон (чуждый).
Сначала считалось, что инертные газы могут
представлять интерес только как объект научного исследования и никакого
практического применения они не найдут. Однако в своих исследованиях,
начатых им в 1910 г., французский химик Жорж Клод (1870—1960) показал,
что электрический ток, пропускаемый через некоторые газы, подобные
неону, вызывает мягкое окрашенное свечение.
Практическое применение этого свойства хорошо
известно: таким газом можно заполнять трубки, изогнутые в виде букв,
слов, фигур и т. п., и уже в 40-х годах нашего столетия улицы больших
городов заливал неоновый свет.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К