Цели урока:
- продолжить формирование понятия скорости
химической реакции; ознакомить учащихся с
факторами, влияющими на скорость химических
реакций;
- прививать им навыки практической работы и на
основании своих наблюдений, полученных в
результате экспериментов, делать выводы об
условиях проведения реакций;
- научить решать типовые задачи.
Оснащение:
На столе учителя: штатив для пробирок,
пробирка, перекись водорода, оксид марганца,
лучина, спички.
На отдельных столах учащихся:
1) цинк гранулированный, кусочек меди, соляная
кислота, две пробирки, штатив для пробирок;
2) железо (порошок), железо(скрепка), серная
кислота, две пробирки, штатив для пробирок,
лопаточка;
3) цинк гранулированный, серная кислота, вода,
стакан, две пробирки, штатив для пробирок;
4) цинк гранулированный, серная кислота
разбавленная, две пробирки, штатив для пробирок,
спиртовка, спички, зажим для пробирок;
5) в вытяжном шкафу: алюминий (порошок),
йод кристаллический, ступа с пестиком, вода,
пипетка.
Ход урока
1. Актуализация опорных знаний:
- Что такое скорость химической реакции?
- Что изменяется при проведении химической
реакции с течением времени?
Проверка домашнего задания.
2. Изучение нового материала.
План:
- Факторы, влияющие на скорость химических
реакций;
- Правило Вант-Гоффа, температурный коэффициент;
- Катализаторы и ингибиторы.
(Класс делится на пять "исследовательских”
групп – по числу факторов).
В жизни часто приходится управлять скоростью
реакции. Для разжигания угля в топке нужно
ускорить реакцию, а для тушения пожара замедлить
и прекратить совсем. Выплавку металла на
металлургических заводах нужно ускорить, а
процесс ржавления железа по возможности
замедлить, поскольку прекратить совсем эту
реакцию мы не можем.
Чтобы управлять скоростью реакции, нужно знать,
от чего она зависит. Существует несколько
факторов, от которых зависит скорость реакции,
познакомимся с ними [1]. Для этого обратимся к
помощи "исследовательских” групп, в которых
будут работать наши учащиеся.
Первая группа учащихся выполняет опыт по
исследованию растворимости двух металлов в
соляной кислоте. Предварительно проходит
инструктаж по технике безопасности. В две
пробирки наливается одинаковое количество
соляной кислоты. В одну из них кладётся таблетка
цинка, а в другую – кусочек меди. Учащиеся
наблюдают за происходящими процессами, и весь
класс делает выводы: цинк растворяется, а медь не
растворяется в соляной кислоте, следовательно,
для получения водорода необходимо брать цинк, а
не медь. Первый фактор - это природа реагирующих
веществ. Учащиеся выходят к доске и записывают
уравнения реакций:
Zn + 2HCl 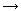 ZnCl2 + H2 ZnCl2 + H2
Cu + HCl реакция не идёт. реакция не идёт.
Одновременно ведутся соответствующие записи в
тетрадях.
Вторая группа учащихся проверяет скорость
растворимости железа в двух видах: в виде порошка
и в виде кусочка (скрепки) в серной кислоте. В две
пробирки наливается одинаковое количество
серной кислоты. Затем в одну из них насыпается
железо порошок, а в другую опускается железная
скрепка. В той пробирке, где находился порошок,
реакция идёт бурно. Там же, куда опустили скрепку
– реакция еле заметна. На основании наблюдений
учащиеся делают вывод, что прежде, чем проводить
реакцию, надо измельчить вещества, а ещё лучше
вести реакции в растворах. Второй фактор – площадь
соприкосновения реагирующих веществ. Чем она
больше, тем быстрее идёт реакция. Учитель
объясняет, что чтобы происходила реакция,
необходимо наличие частиц участвующих веществ:
чем их больше, тем чаще они встречаются, тем
быстрее идёт реакция. Учащиеся записывают
уравнение реакции:
Fe + H2SO4 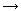 FeSO4 + H2 FeSO4 + H2
Третья группа учащихся испытывает скорость
растворимости цинка в серной кислоте различной
концентрации. В одну из пробирок наливается
примерно 2 мл серной кислоты. В другую пробирку
наливаем один мл воды и один мл серной кислоты.
(Предварительно вспоминаем правила разбавления
кислот водой). В обе пробирки опускаем по
таблеточке цинка. Реакция цинка с неразбавленной
серной идёт быстрее, чем с разбавленной. Учащиеся
делают соответствующий вывод. Третий фактор – концентрация
реагирующих веществ. (Объяснение учителя
аналогично предыдущему). Учащиеся записывают
уравнение реакции:
Zn + H2SO4  ZnSO4 + H2 ZnSO4 + H2
Четвёртая исследовательская группа проверяет
скорость растворимости цинка при нагревании. В
обе пробирки нальём одинаковое количество
разбавленной серной кислоты, в которые опустим
по кусочку цинка. Одну из пробирок нагреем на
спиртовке, реакция сильно ускорится. (Правила по
технике безопасности работы со спиртовкой).
Учащиеся делают выводы, а учитель рассказывает
им о правиле Вант-Гоффа: при повышении
температуры на каждые 100С скорость
большинства реакций увеличивается в 2-4 раза.
Число, показывающее, во сколько раз
увеличивается скорость реакции, обозначается
латинской буквой ? и называется температурным
коэффициентом. Изменение скорости реакции можно
посчитать по следующей формуле:
v2/v1 = 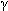 (t1 - t2)/10, (t1 - t2)/10,
где v1 – скорость реакции до нагревания;
v2 – скорость реакции после нагревания;
t10 – температура до нагревания;
t20 – температура после нагревания;
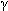 –
температурный коэффициент. –
температурный коэффициент.
Учащиеся записывают формулу в тетрадях.
Итак, четвёртый фактор – температура. Объяснение
учителя: необходимо не только наличие, но и
движение частиц реагирующих веществ. А чем выше
температура, тем более интенсивным становится
движение, тем чаще они встречаются друг с другом,
тем быстрее идёт реакция.
Решим задачу: во сколько раз изменится скорость
реакции при увеличении температуры от 200 до
600С. Температурный коэффициент равен двум.
(Один из учащихся вызывается к доске).
Пятая группа учащихся выполняет опыт в
вытяжном шкафу. В ступу насыпаем немного порошка
алюминия и йод кристаллический. Всё это
разминаем осторожно пестиком. Делаем кучу.
Капаем одну - две капли воды. Через несколько
секунд начинается бурная реакция, выделяется
фиолетовый дым. Говорим, что реакция пошла,
благодаря присутствию воды, она сыграла роль
катализатора. Катализаторы – это ускорители или
инициаторы реакций, сами в результате реакций не
изменяются. При этом происходит понижение
значения энергии активации, и реакция идёт легче.
Есть вещества противоположные катализаторам –
ингибиторы. Ингибиторы – это замедлители
реакций. Учащиеся делают вывод, что пятым
фактором является присутствие некоторых
веществ – катализаторов и ингибиторов.
Записываем уравнение реакции:
H2O
2Al + 3J2  2AlJ3 2AlJ3
Подтверждая пятый фактор, учитель
демонстрирует опыт с разложением перекиси
водорода. В пробирку наливаем немного перекиси
водорода и насыпаем туда порошок оксида
марганца. Идёт бурная реакция. Быстро зажигаем
лучину, гасим её, а затем опускаем в пробирку: она
тот час загорается вновь. Спрашиваем у учащихся,
какой газ выделился? Они отвечают, что это
кислород. Какую роль сыграл здесь оксид марганца?
Роль катализатора.
MnO2
2H2O2  2H2O + O2 2H2O + O2
Подведём итоги. Какие факторы влияют на
скорость химических реакций?
- Природа реагирующих веществ.
- Площадь соприкосновения реагирующих веществ.
- Концентрация реагирующих веществ.
- Температура.
- Присутствие катализаторов и ингибиторов.
3. Домашнее задание: &&13,14 читать,
упражнения в тетрадях.
Так как объяснение нового материала
сопровождалось химическими опытами, которые
выполняли сами учащиеся, то на закрепление
материала времени может совсем не остаться. В
этом случае следующий урок можно начать с
решения типовых задач. Например,
Реакция протекает по схеме: А + В 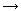 С.
Исходная концентрация вещества А равнялась 0,80
моль/л. Через 20 минут она стала равной 0,78 моль/л. С
какой скоростью протекала реакция? С.
Исходная концентрация вещества А равнялась 0,80
моль/л. Через 20 минут она стала равной 0,78 моль/л. С
какой скоростью протекала реакция?
Во сколько раз изменится скорость реакции при
увеличении температуры от 1000 до 1700С,
если температурный коэффициент реакции равен 3?
На сколько градусов нужно повысить
температуру, чтобы скорость реакции увеличилась
в 27 раз? Температурный коэффициент равен 3.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К