Цели урока:
- Познакомить учащихся с элементом побочной
группы Периодической системы – железом, его
строением, свойствами.
- Знать нахождение железа в природе, способы его
получения, применение, физические свойства.
- Уметь давать характеристику железа как
элемента побочной подгруппы.
- Уметь доказывать химические свойства железа и
его соединений, записывать уравнения реакций в
молекулярном, ионном,
окислительно-восстановительном виде.
- Развивать умения учащихся составлять уравнения
реакций с участием железы, сформировать знания
учащихся о качественных реакциях на ионы
железы.
- Воспитывать интерес к предмету.
Оборудование: железо (порошок,
булавка, пластина), сера, колба с кислородом,
соляная кислота, сульфат железы(II), хлорид
железы(III),гидроксид натрия, красная и желтая
кровяные соли.
ХОД УРОКА
I. Органиционный момент
II. Проверка домашнего задания
III. Изучение нового материала
1. Вступление учителя.
– Значение железа в жизни, его роль в истории
цивилизации. Одним из самых распространенных
металлов в земной коре является железо.
Применять его начали гораздо позже других
металлов (меди, золота, цинка, свинца, олова), что,
скорее всего, объясняется малым сходством руды
железа с металлом. Первобытным людям было очень
трудно догадаться, что из руды можно получить
металл, который успешно можно использовать при
изготовлении различных предметов, сказалось
отсутствие инструментов и необходимых
приспособлений для организации такого процесса.
До того времени, когда человек научился получать
из руды железо и изготавливать из него сталь и
чугун, прошло довольно длительное время.
На данный момент железные руды являются
необходимым сырьем для черной металлургии, теми
полезными ископаемыми, обходиться без которых не
сможет ни одна развитая промышленная страна. За
год мировая добыча железных руд составляет
приблизительно 350 000 000 тонн. Используются они для
выплавки железа (содержание углерода 0,2-0,4 %),
чугуна (2,5-4% углерода), стали (2,5-1,5 % углерода) Сталь
имеет наиболее широкое применение в
промышленности, чем железо и чугун, поэтому и
больше спрос на ее выплавку.
Для выплавки чугуна из железных руд используются
домны, которые работают на каменном угле или
коксе, переплавка стали и железа из чугуна
происходит в отражательных мартеновских печах,
бессемеровских конверторах или способом Томаса.
Черные металлы и их сплавы имеют огромное
значение в жизни и развитии человеческого
общества. Всевозможные предметы быта и широкого
потребления изготавливаются из железа. Для
строительства кораблей, самолетов,
железнодорожного транспорта, автомобилей,
мостов, железных дорог, различных зданий,
оборудования и прочего, используются сотни
миллионов тонн стали и чугуна. Не существует
такой отрасли сельского хозяйства и
промышленности, в которой бы не применялись
железо и его различные сплавы.
Немногие часто встречающиеся в природе минералы,
имеющие в своем составе железо, являются именно
железной рудой. К таким минералам можно отнести:
бурый железняк, гематит, магнетит, другие,
образующие крупные месторождения и занимающие
огромные площади.
Химическое отношение магнетита или магнитного
железняка, имеющего железо – черный цвет и
уникальное свойство – магнитность, представляет
собой соединение, состоящее из окиси и закиси
железа. В природной среде его можно встретить как
в виде зернистых или сплошных масс, так и в виде
хорошо сформированных кристаллов. Железная руда
наиболее богата содержанием металлического
железа магнетита (до 72%).
Самые крупные в нашей стране месторождения
магнетитовых руд находятся на Урале, в горах
Высокая, Благодать, Магнитная, в некоторых
районах Сибири – бассейне реки Ангара, Горной
Шории, на территории Кольского полуострова.
2. Работа с классом. Характеристика железа
как химического элемента
а) Положение в периодической системе:
Задание 1. Определить положение железа
в Периодической системе?
Ответ: Железо расположено в 4-м большом
периоде, четном ряду, 8-й группе, побочной группе.
б) строение атома:
Задание 2. Зарисовать состав и
строение атома железа, электронные формулу и
ячейки.
Ответ: Fe+3 2)8)14)2)
металл
р = 26
е = 26
n = (56 – 26) = 30
1s22s22p63s23p63d64s2
Вопрос. На каких слоях у железа
расположены валентные электроны? Почему?
Ответ. Валентные электроны
расположены на последнем и предпоследнем слоях,
так как это элемент побочной подгруппы.
Железо относят к d-элементам, оно входит в
состав триады элементов – металлов (Fe-Co-Ni);
в) окислительно-восстановительные свойства
железа:
Вопрос. Чем является
железо-окислителем или восстановителем? Какие
степени окисления и валентность проявляет?
Ответ:
Fe0 – 2e = Fe+3 }восстановитель
Fe0 – 3e = Fe+3
с.о.+ 2,+ 3; валентность = II и III, валентность 7 – не
проявляет;
г) соединения железа:
FeO – основный оксид
Fe(OH)2 – нерастворимое основание
Fe2O3 – оксид признаками амфотерности
Fe(OH)3 – основание с признаки амфотерности
Летучие водородные соединения – нет.
д) нахождение в природе.
Железо является вторым по распространенности
металлом в природе(после алюминия).В свободном
состоянии железо встречается только в
метеоритах.Наиболее важные природные
соединения:
FeO*3HO – бурый железняк,
FeO – красный железняк,
FeO (FeO*FeO) – магнитный железняк,
FeS – железный колчедан (пирит)
Соединения железа входят в состав живых
организмов.
3. Характеристика простого вещества железа
а) строение молекулы, тип связи, тип
кристаллической решетки;(самостоятельно)
б) физические свойства железа
Железо – серебристо-серый металл, обладает
большой ковкостью, пластичностью и сильными
магнитными свойствами. Плотность железа – 7,87г/см3,
температура плавления 1539 tоС.
в) химические свойства железа:
Атомы железа в реакциях отдают электроны и
проявляют степени окисления + 2,+ 3 и иногда + 6.
В реакциях железо является восстановителем.
Однако при обычной температуре оно не
взаимодействует даже с самыми октивными
окислителями(галогенами,кислородом,серой) но при
нагревании становится активными и реагирует с
ними:
2Fe +3Cl2 = 2FeCl3 Хлорид
железа(III)
3Fe + 2O2 = Fe2O3 (FeO*Fe O) Оксид
железа(III)
Fe +S =
FeS
Сульфид железа(II)
При очень высокой температуре железо
реагирует с углеродом, кремнием и фосфором.
3Fe + C = Fe3C
Карбид
железа(цементит)
3Fe + Si = Fe3Si
Силицид железа
3Fe + 2P = Fe3P2 Фосфид
железа
Железо реагирует со сложными веществами.
Во влажном воздухе железо быстро
скисляется(корродирует):
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Fe(OH)3 ––> FeOOH + H2O
Ржавчина
Железо находится в середине
электрохимического ряда напряжений
металлов,поэтому является металлом средней
активности. Восстановительная способность
у железаменьше, чем у щелочных, щелочноземельных
металлов и у алюминия. Только при высокой
температуре раскаленное железо реагирует с
водой:
3Fe + 4H2O = Fe3O4 + 4H2
Железо реагирует с разбавленными серной и
соляной кислотами,вытесняя из них водород:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
Fe0 + 2H+ = Fe2+ + H20
При обычной температуре железо не
взаимодействует с концентрированной серной
кислотой, так как пассивируется ею.При
нагревании концентрированная серная кислота
окисляет железо до сульфата железа(III):
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2
+ 6H2O
Разбавленная азотная кислота окисляет железо
до нитрата железа(III):
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Концентрированная азотная кислота пассивирует
железо.
Из растворов солей железо вытесняет металлы,
которые расположены правее его в
электрохимическом ряду напряжений:
Fe + CuSO4 = FeSO4 + Cu,
г) применение железа (самостоятельно)
д) получение (вместе с учащимися)
В промышленности железо получают
восстановлением его из железных руд углеродом
(коксом) и оксидом углерода (II) в доменных печах.
Химизм доменного процесса следующий:
C + O = CO
CO + C = 2CO
3Fe2O3 + CO = 2Fe3O4 + CO2
Fe3O4 + CO = 3FeO + CO2
FeO + CO = Fe + CO2
4. Соединения железа
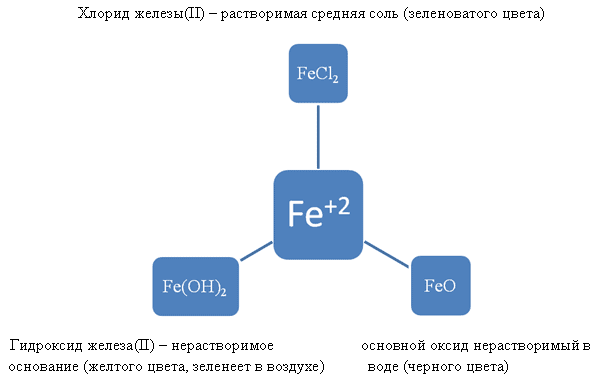
Химические свойства данных соединений.
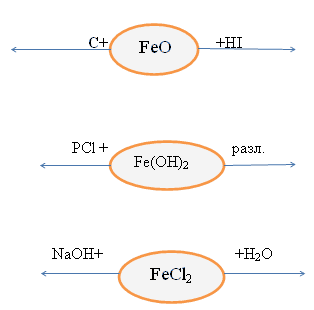
Дополнение. Соединения железа(II)
неустойчивы, они могут они могут окисляться и
переходить в соединения железа(III)
Fe+2 Cl2 + Cl2 = Fe+3 Cl3 составить
дома окислительно-восстановительные
Fe+2 (OH) + H2O + O2 = Fe+3(OH)3
схемы, уравнять.
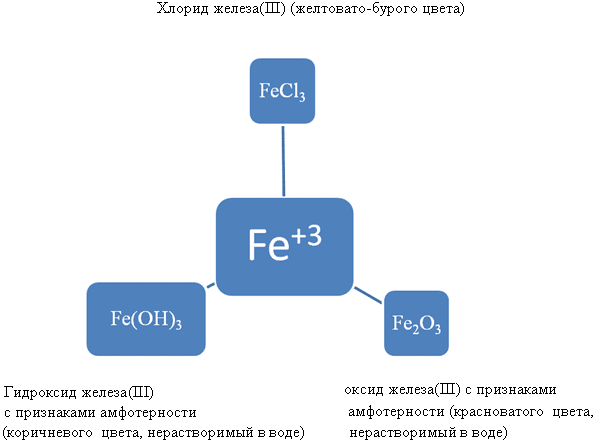
Химические свойства данных соединений
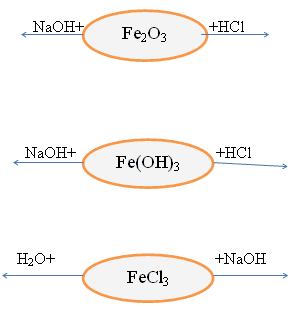
Также качественной реакцией на Fe+2 служит
реакция солей железа(II) с веществом ,называемым
красный кровяной солью K3[Fe(CN)6] – это
комплексное соединение.
3FeCl + 2K3[Fe(CN6)] = Fe3[Fe(CN6)2
+ 6KCl
Образуется темно-синий осадок
А качественной реакций на Fe+3 служит
реакция солей железа(III) с роданидом калия KCNS или
роданидом аммония NH4CNS
FeCl3 + 3KCNS = Fe(CNS)3 + 3KCl
Образуется роданид железа(III)
темно-красного цвета
IV. Закрепление знаний, умений, навыков
V. Задание на дом: составить кроссворд
на тему железа.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К