Что такое раствор
Если посолить бульон и размешать ложкой, то
не останется и следов соли. Не следует думать, что крупинок соли просто
не видно невооруженным глазом. Кристаллики соли никаким способом не
удастся обнаружить по той причине, что они растворились. Если подбавить в
бульон перца, то раствора не получится. Можно перемешивать бульон хоть
сутками - крошечные черные крупинки не исчезнут.
Но что значит - "вещество растворилось"?
Ведь атомы или молекулы, из которого оно построено, не могут пропасть
бесследно? Конечно, нет, они и не пропадают. При растворении исчезает
лишь крупинка вещества, кристаллик, скопление молекул одного сорта.
Растворение состоит в таком перемешивании частиц смеси, при котором
молекулы одного вещества распределяются между молекулами другого.
Раствор -- это смесь молекул или атомов разных веществ.
Раствор может содержать различные
количества растворенного вещества. Состав раствора характеризуется его
концентрацией, например, отношением числа граммов растворенного вещества
к числу литров раствора.
По мере добавления растворяемого вещества
концентрация раствора растет, но не беспредельно. Рано или поздно
раствор становится насыщенным и перестает "принимать в себя"
растворяемое вещество. Концентрация насыщенного раствора, т. е.
"предельная" концентрация раствора, называется растворимостью.
Удивительно много сахара можно растворить в
горячей воде. При температуре 80°С полный стакан воды примет без
остатка 720 г сахара. Этот насыщенный раствор будет густым и вязким,
повара называют его сахарным сиропом. Мы привели для сахара цифру для
граненого стакана, емкость которого 0,2 л. Значит, концентрация сахара в
воде при 80°С равняется 3600 г/л (читается: "грамм на литр").
Растворимость некоторых веществ сильно
зависит от температуры. При комнатной температуре (20°С) растворимость
сахара в воде падает до 2000 г/л. Напротив, растворимость соли совершенно незначительно меняется с изменением температуры.
Сахар и соль хорошо растворяются в воде. А
вот нафталин в воде практически нерастворим. Различные вещества в
различных растворителях растворяются совершенно различно. Повторим еще
раз, что в очень многих случаях растворами пользуются для выращивания
монокристаллов. Если подвесить в насыщенный раствор маленький кристаллик
растворенного вещества, то по мере испарения растворителя растворенное
вещество будет высаживаться на поверхности этого кристаллика. При этом
молекулы будут соблюдать строгий порядок, и в результате маленький
кристаллик превратится в большой, оставаясь монокристаллом.
Растворы жидкостей и газов
Можно ли растворить жидкость в жидкости?
Разумеется, можно. Например, водка - это раствор спирта в воде (или,
если угодно, воды в спирте,- смотря чего больше). Водка - настоящий
раствор, молекулы воды и спирта полностью перемешаны в ней.
Однако не всегда при смешении двух жидкостей получится такой результат.
Попробуйте подлить к воде керосин. Никаким
перемешиванием не удастся получить однородный раствор, это так же
безнадежно, как растворять перец в супе. Как только перемешивание
прекращается, жидкости располагаются слоями: более тяжелая вода - внизу,
более легкий керосин - наверху. Керосин с водой и спирт с водой -
системы, противоположные по свойствам растворимости.
Однако имеются и промежуточные случаи. Если
смешать эфир с водой, то мы отчетливо увидим в сосуде два слоя. На
первый взгляд может показаться, что сверху эфир, а внизу вода. На самом
же деле и нижний и верхний слои являются растворами: внизу - вода, в
которой растворилась часть эфира (концентрация 25 г эфира на литр воды),
а наверху - эфир, в котором имеется заметное количество воды (60 г/л).
Теперь поинтересуемся растворами газов.
Ясно, что все газы растворяются друг в друге в неограниченных
количествах. Два газа всегда перемешиваются так, что молекулы одного
проникают между молекулами другого. Ведь молекулы газов мало
взаимодействуют друг с другом, и каждый газ ведет себя в присутствии
другого газа, в некотором смысле не обращая "внимания" на своего
сожителя.
Газы могут растворяться и в жидкостях.
Однако уже не в любых количествах, а в ограниченных, не отличаясь в этом
отношении от твердых веществ. При этом разные газы растворяются
по-разному, и различия эти могут быть очень большими. В воде можно
растворить огромные количества аммиака (на полстакана холодной воды -
около 100 г), большие количества сероводорода и углекислоты. В
незначительном количестве растворимы в воде кислород и азот (0,07 и 0,03
г на литр холодной воды). Таким образом, в литре холодной воды
находится всего лишь около сотой грамма воздуха. Однако и это маленькое
количество играет большую роль в жизни на Земле - ведь растворенным в
воде кислородом воздуха дышат рыбы.
Чем больше давление газа, тем больше его
растворится в жидкости. Если количество растворенного газа не очень
велико, то между ним и давлением газа над поверхностью жидкости имеется
прямая пропорциональность.
Кто не получал удовольствия от холодной
газированной воды, так хорошо утоляющей жажду! Получение газированной
воды возможно благодаря зависимости количества растворенного газа от
давления. Углекислый газ загоняют в воду под давлением (из баллонов,
которые имеются у каждого киоска, где продают газированную воду). Когда
воду наливают в стакан, давление падает до атмосферного и вода выделяет
"лишний" газ в виде пузырьков.
Учитывая подобные эффекты, водолазов нельзя
быстро поднимать из воды на поверхность. Под большим давлением на
глубине в крови водолаза растворяется дополнительное количество воздуха.
При подъеме давление падает, воздух начинает выделяться в виде
пузырьков и может закупорить кровеносные сосуды.
Твердые растворы
В жизни слово "раствор" применяют к
жидкостям. Однако существуют и твердые смеси, атомы или молекулы которых
однородно перемешаны. Но как получить твердые растворы? При помощи
пестика и ступки их не получишь. Поэтому смешивающиеся вещества надо
сначала сделать жидкими, т. е. расплавить, потом смешать жидкости и дать
смеси затвердеть. Можно поступить и иначе - растворить два вещества,
которые мы хотим смешать, в какой-либо жидкости, а затем уже выпарить
растворитель. Такими способами могут получиться твердые растворы. Могут
получиться, но обычно не получаются. Твердые растворы - это редкость.
Если в соленую воду бросить кусок сахара, он превосходно растворится.
Выпарим воду; на дне чашки обнаружатся мельчайшие кристаллики соли и
сахара. Соль с сахаром не дают твердых растворов.
Можно расплавить в одном тигле кадмий с
висмутом. После охлаждения мы увидим в микроскоп смесь кристалликов
кадмия и висмута. Висмут и кадмий тоже не образуют твердых растворов.
Необходимым, хотя и не достаточным,
условием возникновения твердых растворов является близость молекул или
атомов смешивающихся веществ по форме и размерам. В этом случае при
замерзании смеси образуется один сорт кристалликов. Узлы решетки каждого
кристалла обычно беспорядочно заселены атомами (молекулами) разных
сортов.
Сплавы металлов, имеющие большое
техническое значение, зачастую представляют собой твердые растворы.
Растворением небольшого количества примеси можно резко изменить свойства
металла. Яркой иллюстрацией этого является получение одного из наиболее
распространенных в технике материалов - стали, представляющей собой
твердый раствор малых количеств углерода - порядка 0,5 весового процента
(один атом углерода на 40 атомов железа) - в железе, причем атомы
углерода беспорядочно внедрены между атомами железа.
В железе растворяется лишь небольшое число
атомов углерода. Однако некоторые твердые растворы образуются при
смешении веществ в любых пропорциях. Примером может служить сплав золото
- медь. Кристаллы золота и меди имеют решетку одинакового типа -
кубическую гранецентрированную. Такую же решетку имеет сплав меди с
золотом. Представление о структуре сплава со все увеличивающейся долей
меди мы получим, если будем мысленно удалять из решетки атомы золота и
заменять их атомами меди. При этом замена происходит беспорядочно, атомы
меди распределяются в общем как попало по узлам решетки. Сплавы меди с
золотом можно назвать растворами замещения, а сталь является раствором
иного типа - раствором внедрения.
В подавляющем же большинстве случаев
твердых растворов не возникает, и, как говорилось выше, после застывания
мы можем увидеть в микроскоп, что вещество состоит из смеси мелких
кристалликов обоих веществ.
Как замерзают растворы
Если охладить раствор какой-либо соли в
воде, то обнаружится, что температура замерзания понизилась. Нуль
градусов пройден, а затвердевание не происходит. Только при температуре
на несколько градусов ниже нуля в жидкости появятся кристаллики. Это
кристаллики чистого льда, в твердом льде соль не растворяется.
Температура замерзания зависит от
концентрации раствора. Увеличивая концентрацию раствора, мы будем
уменьшать температуру кристаллизации. Самую низкую температуру
замерзания имеет насыщенный раствор. Понижение температуры замерзания
раствора совсем не малое: так, насыщенный раствор поваренной соли в воде
замерзнет при - 21 °С. При помощи других солей можно добиться еще
большего понижения температуры; хлористый кальций, например, позволяет
довести температуру затвердевания раствора до -55°С.
Рассмотрим теперь, как идет процесс
замерзания. После того как из раствора выпадут первые кристаллики льда,
крепость раствора увеличится. Теперь относительное число чужих молекул
возрастет, помехи процессу кристаллизации воды также увеличатся, и
температура замерзания упадет. Если не понижать температуру далее, то
кристаллизация остановится.
При дальнейшем понижении температуры
кристаллики воды (растворителя) продолжают выделяться. Наконец, раствор
становится насыщенным. Дальнейшее обогащение раствора растворенным
веществом становится невозможным, и раствор застывает сразу, причем если
рассмотреть в микроскоп замерзшую смесь, то можно увидеть, что она
состоит из кристалликов льда и кристалликов соли.
Таким образом, раствор замерзает не так,
как простая жидкость. Процесс замерзания растягивается на большой
температурный интервал.
Что получится, если посыпать какую-нибудь
обледеневшую поверхность солью? Ответ па вопрос хорошо известен
дворникам: как только соль придет в соприкосновение со льдом, лед начнет
таять. Чтобы явление имело место, нужно, конечно, чтобы температура
замерзания насыщенного раствора соли была ниже температуры воздуха. Если
это условие выполнено, то смесь лед - соль находится в чужой области
состояния, а именно в области устойчивого существования раствора.
Поэтому смесь льда с солью и будет превращаться в раствор, т. е. лед
будет плавиться, а соль растворяться в образующейся воде. В конце концов
либо весь лед растает, либо образуется раствор такой концентрации,
температура замерзания которого равна температуре среды.
Площадь дворика в 100 м2 покрыта
ледяной коркой в 1 см - это уже не мало льда, около 1 т. Подсчитаем,
сколько соли нужно для очистки двора, если температура -3°С. Такой
температурой кристаллизации (таяния) обладает раствор соли с
концентрацией 45 г/л. Примерно 1 л воды
соответствует 1 кг льда. Значит, для таяния 1 т льда при -3°С нужно 45
кг соли. Практически пользуются гораздо меньшими количествами, так как
не добиваются полного таяния всего льда.
При смешении льда с солью лед плавится, а
соль растворяется в воде. Но на плавление нужно тепло, и лед забирает
его у своего окружения. Таким образом, добавление соли ко льду приводит к
понижению температуры.
Мы привыкли сейчас покупать фабричное
мороженое. Раньше мороженое готовили дома, и при этом роль холодильника
играла смесь льда с солью.
Кипение растворов
Явление кипения растворов имеет много общего с явлением замерзания.
Наличие растворенного вещества затрудняет
кристаллизацию. По тем же самым причинам растворенное вещество
затрудняет и кипение. В обоих случаях чужие молекулы как бы борются за
сохранение как можно более разбавленного раствора. Иными словами, чужие
молекулы стабилизируют состояние основного вещества (т.е. способствуют
его существованию), которое может их растворить.
Поэтому чужие молекулы мешают жидкости
кристаллизоваться, а значит, понижают температуру кристаллизации. Точно
так же чужие молекулы мешают жидкости кипеть, а значит, повышают ее
температуру кипения.
Любопытно, что до известных пределов
концентрации (для не очень крепких растворов) как понижение температуры
кристаллизации раствора, так и повышение температуры кипения нисколько
не зависят от свойств растворенного вещества, а определяются лишь
количеством его молекул. Это интересное обстоятельство используется для
определения молекулярной массы растворяемого вещества. Делается это при
помощи замечательной формулы (мы не можем здесь привести ее), которая
связывает изменение температуры замерзания или кипения с количеством
молекул в единице объема раствора (и с теплотой плавления или кипения).
Температура кипения воды повышается раза в
три меньше, чем понижается температура ее замерзания. Так, морская вода,
содержащая примерно 3,5 % солей, имеет точку кипения 100,6°С,; в то
время как температура ее замерзания понижается на 2°С.
Если одна жидкость кипит при более высокой
температуре, чем другая, то (при той же температуре) упругость ее пара
меньше. Значит,- упругость пара раствора меньше упругости пара чистого
растворителя.
О различии можно судить по следующим
цифрам: упругость водяного пара при 20°С равна 17,5 мм рт. ст.,
упругость пара насыщенного раствора поваренной соли при той же
температуре - 13,2 мм рт. ст.
Пар с упругостью 15 мм рт. ст.,
ненасыщенный для воды, будет пересыщен для насыщенного раствора соли. В
присутствии такого раствора пар начнет конденсироваться и переходить в
раствор. Разумеется, забирать водяной пар из воздуха будет не только
раствор соли, но и соль в порошке. Ведь первая же капелька воды,
выпавшая на соль, растворит ее и создаст насыщенный раствор.
Всасывание солью водяного пара из воздуха
приводит к тому, что соль становится сырой. Это хорошо знакомо хозяйкам и
доставляет им огорчения. Но это явление понижения упругости пара над
раствором приносит и пользу: оно используется для сушки воздуха в
лабораторной практике. Воздух пропускают через хлористый кальций,
который является рекордсменом по забиранию влаги из воздуха. Если у
насыщенного раствора поваренной соли упругость пара 13,2 мм рт. ст., то у
хлористого кальция она 5,6 мм рт. ст. До такого значения упадет
упругость водяного пара при пропускании его через достаточное количество
хлористого кальция (1 кг которого "вмещает" в себя примерно 1 кг воды).
Это ничтожная влажность, и воздух может считаться сухим.
Как очищают жидкости ит примесей
Одним из важнейших способов очистки
жидкостей от примесей является перегонка. Жидкость кипятят и направляют
пар в холодильник. При охлаждении пар опять превращается в жидкость, но
эта жидкость будет чище исходной.
При помощи перегонки легко избавиться от
твердых веществ, растворенных в жидкости. Молекулы таких веществ
практически отсутствуют в паре. Этим способом получают дистиллированную
воду - совершенно безвкусную чистую воду, лишенную минеральных примесей,
Однако, используя испарение, можно
избавиться и от жидких примесей и разделить смесь, состоящую из двух или
более жидкостей. При этом пользуются тем, что две жидкости, образующие
смесь, кипят не одинаково.
Посмотрим, как будет себя вести при кипении
смесь двух жидкостей, например смесь воды и этилового спирта, взятых в
равных пропорциях (50-градусная водка).
При нормальном давлении вода закипает при
100°С, а спирт при 78°С. Смесь, о которой идет речь, закипит при
промежуточной температуре, равной 81,2°С. Спирт кипит легче, поэтому
упругость его пара больше, и при исходном пятидесятипроцентном составе
смеси первая порция пара будет содержать 80 % спирта.
Полученную порцию пара можно отвести в
холодильник и получить жидкость, обогащенную спиртом. Далее этот процесс
можно повторять. Однако ясно, что практику такой способ не устроит -
ведь с каждой последующей перегонкой будет получаться все меньше
вещества. Чтобы такой потери не было, для целей очистки применяются так
называемые ректификационные (т. е. очистительные) колонки.
Идея устройства этого интересного аппарата
заключается в следующем. Представим себе вертикальную колонку, в нижней
части которой находится жидкая смесь. К низу колонки подводится тепло,
вверху производится охлаждение. Пар, образующийся при кипении,
поднимается кверху и конденсируется; образовавшаяся жидкость стекает
вниз. При неизменном подводе тепла к низу и отводе тепла сверху в
закрытой колонке установятся встречные потоки пара, идущего кверху, и
жидкости, стекающей вниз.
Остановим свое внимание на каком-либо
горизонтальном сечении колонки. Через это сечение жидкость проходит
вниз, а пар поднимается, при этом ни одно из веществ, входящих в состав
жидкой смеси, не задерживается. Если речь идет о колонке, заполненной
смесью спирта и воды, то количества спирта, проходящего вниз и вверх,
так же как количества воды, проходящей вниз и вверх, будут равны. Так
как вниз идет жидкость, а вверх пар, то это значит, что на любой высоте
колонки состав жидкости и состав пара одинаковы.
Как только что было выяснено, равновесие
жидкости и пара смеси двух веществ требует, напротив, разного состава
жидкой и парообразной фаз.
Поэтому на любой высоте колонки происходит
превращение жидкости в пар и пара в жидкость. При этом конденсируется
высококипящая часть смеси, а из жидкости в пар переходит низкокипящая
составляющая.
Поэтому идущий вверх поток пара будет как
бы забирать со всех высот низкокипящую составляющую, а стекающий вниз
поток жидкости будет непрерывно обогащаться высококипящей частью. Состав
смеси на каждой высоте установится различный: чем выше, тем больше
процент низкокипящей составляющей. В идеале наверху будет слой чистой
низкокипящей составляющей, а внизу - слой чистой высококипящей.
Теперь надо, только по возможности
медленно, чтобы не нарушить обрисованной идеальной картины, отбирать
вещества, низкокипящее - сверху, а высококипящее - снизу.
Для того чтобы практически осуществить
разделение, или ректификацию, надо дать возможность встречным потокам
пара и жидкости как следует перемешиваться. Для этой цели потоки
жидкости и пара задерживают при помощи тарелок, расположенных одна над
другой и сообщающихся сливными трубками. С переполненной тарелки
жидкость может стекать на нижние ступеньки. Пар, идущий вверх быстрым
потоком (0,3 - 1 м/с), прорывается через тонкий слой жидкости. Схема
колонки показана на рис. 5.1.
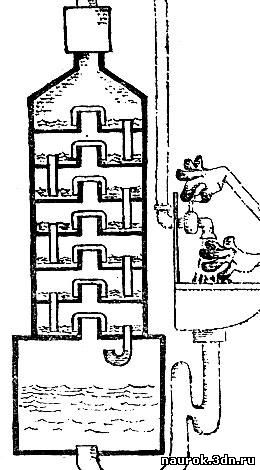
Рис 5.1
Не всегда удается очистить жидкость
полностью. Некоторые смеси обладают "неприятным" свойством: при
определенном составе смеси соотношение компонент испаряющихся молекул
такое же, что и соотношение компонент в жидкой смеси. В этом случае,
разумеется, дальнейшая очистка описанным способом становится
невозможной. Такова смесь, содержащая 96% спирта и 4% воды: она дает пар
такого же состава. Поэтому 96%-ный спирт - самый лучший, который можно
получить методом испарения.
Ректификация (или дистилляция) жидкостей
является важнейшим процессом в химической технологии. При помощи
ректификации добывают, например, бензин из нефти.
Любопытно, что ректификация является
наиболее дешевым способом получения кислорода. Для этого, разумеется,
надо предварительно перевести воздух в жидкое состояние, после чего
можно ректификацией разделить его на почти чистые азот и кислород.
Очистка твердых тел
На склянке с химическим веществом, как
правило, можно увидеть рядом с химическим названием такие буквы: "ч.",
"ч. д. а." или "сп. ч.". Этими буквами условно отмечают степень чистоты
вещества: "ч." означает весьма небольшую степень чистоты - в веществе,;
возможно, есть примеси порядка 1%; "ч. д. а." - вещество "чистое для
анализа" -- содержит не более нескольких десятых процента примесей; "сп.
ч." - спектрально чистое вещество - получить нелегко, спектральный
анализ обнаруживает тысячные доли примеси. Надпись "сп. ч." позволяет
надеяться,; что вещество по своей чистоте характеризуется по крайней
мере "четырьмя девятками", т. е. что содержание основного вещества не
менее 99,99%.
Потребность в чистых твердых веществах
весьма велика. Для многих физических свойств вредны тысячные доли
процента примесей, а в одной специальной задаче, чрезвычайно
интересующей современную тех-никуя а именно в задаче получения
полупроводниковых материалов, техники требуют чистоты в семь девяток.
Это значит, что решению инженерных задач
мешает один ненужный атом на десять миллионов нужных! Для получения
таких сверхчистых материалов прибегают к специальным методам.
Сверхчистые германий и кремний (это и есть
главные представители полупроводниковых материалов) можно получить
медленным вытягиванием растущего кристалла из расплава. К поверхности
расплавленного кремния (или германия) подводят стержень, на конце
которого укреплен затравочный кристалл. Затем начинают медленно
поднимать стержень; вылезающий из расплава кристалл образуется атомами
основного вещества, атомы примеси остаются в расплаве.
Более широкое применение получил метод так
называемой зонной плавки. Из очищаемого элемента приготовляется пруток
произвольной длины диаметром в несколько миллиметров. Вдоль прутка
перемещается охватывающая его маленькая цилиндрическая печь.
Температура печи достаточна для плавления, и
участок металла, находящийся внутри печи, плавится. Таким образом,
вдоль стержня передвигается маленькая зона расплавленного металла.
Атомы примеси обычно значительно легче
растворяются в жидкости, чем в твердом теле. Поэтому на границе
расплавленной зоны атомы примеси из твердых участков переходят в
расплавленную зону и не переходят обратно. Передвигающаяся расплавленная
зона как бы тащит атомы примеси вместе с расплавом. При обратном ходе
печь выключается и операция протаскивания расплавленной зоны через
пруток металла многократно повторяется. После достаточного числа циклов
остается лишь отпилить загрязненный конец прутка. Сверхчистые материалы
получают в вакууме или в атмосфере инертного газа.
При большой доле чужих атомов очистку
производят другими методами, зонную плавку и вытягивание кристалла из
расплава применяют лишь для окончательной очистки материала.
Адсорбция
Газы редко растворяются в твердых телах, т.
е. редко проникают внутрь кристаллов. Зато существует иной способ
поглощения газов твердыми телами. Молекулы газа скапливаются на
поверхности твердого тела - это своеобразное прилипание называется
адсорбцией. Итак, адсорбция происходит тогда, когда молекула не
может проникнуть внутрь тела, но зато успешно цепляется за его
поверхность.
Адсорбироваться - это значит поглощаться
поверхностью. Но разве может такое явление играть сколько-нибудь
значительную роль? Ведь слой толщиной в одну молекулу, нанесенный на
самый крупный предмет, будет весить ничтожные доли грамма.
Подсчитаем. Площадь небольшой молекулы - что-нибудь около 10 Å2, т. е. 10-15 см2. Значит, на 1 см2 уместится 1015 молекул. Такое количество молекул, скажем, воды весит немного, 3*10-8 г. Даже на квадратном метре разместится всего 0,0003 г воды.
Заметные количества вещества образуются на поверхностях в сотни квадратных метров. На 100 м2 приходится уже 0,03 г воды (1021 молекул).
Но разве мы сталкиваемся с такими
значительными поверхностями в лабораторной практике? Однако нетрудно
сообразить, что иногда совсем маленькие тела, уменьшающиеся на конце
чайной ложечки, имеют огромные поверхности в сотни квадратных метров.
Кубик со стороной в 1 см имеет площадь поверхности 6 см2. Разрежем кубик на 8 равных кубиков со стороной 0,5 см. Маленькие кубики имеют грани площадью 0,25 см2. Всего таких граней 6*8 = 48. Их общая площадь равна 12 см2. Поверхность удвоилась.
Итак, всякое раздробление тела увеличивает
его поверхность. Раздробим теперь кубик со стороной 1 см на частички
размером в 1 микрометр: 1 мкм=10-4 см, значит, большой кубик
разобьется на 1012 частиц. Каждая частичка (для простоты допустим, что и
она кубическая) имеет площадь 6 мкм2, т. е. 6*10-8 см2. Общая площадь частиц равна 6*104 см2, т. е. 6 м2. А дробление до микрометра совсем не является пределом.
Вполне попятно, что удельная поверхность
(т. е. поверхность одного грамма вещества) может выражаться огромными
цифрами. Она быстро растет по мере измельчения вещества - ведь
поверхность зернышка уменьшается пропорционально квадрату размера, а
число зерен в единице объема растет пропорционально кубу размера. Грамм
воды, налитой на дно стакана, имеет поверхность в несколько квадратных
сантиметров. Тот же грамм воды в виде дождевых капель уже будет иметь
поверхность, измеряемую десятками квадратных сантиметров. А один грамм
капелек тумана имеет поверхность в несколько сот квадратных метров.
Если раздробить уголь (чем мельче, тем
лучше), то он способен адсорбировать аммиак, углекислоту, многие
ядовитые газы. Это последнее свойство обеспечило углю применение в
противогазе. Уголь дробится особенно хорошо, и линейные размеры его
частиц могут быть доведены до десятка ангстрем. Поэтому один грамм
специального угля имеет поверхность в несколько сот квадратных метров.
Противогаз с углем способен поглотить десятки литров газа.
Адсорбция широко используется в химической
промышленности. Молекулы различных газов, адсорбируясь на поверхности,
приходят в тесное соприкосновение одна с другой и легче вступают в
химические реакции.
Для ускорения химических процессов Часто используют как уголь, так и мелко раздробленные металлы - никель, медь и другие.
Вещества, ускоряющие химическую реакцию, называются катализаторами.
Осмос
Среди животных тканей есть своеобразные
пленки, которые обладают способностью пропускать через себя молекулы
воды, оставаясь непроницаемыми для молекул растворенных в воде веществ.
Свойства этих пленок являются причиной физических явлений, носящих название осмотических (или просто осмоса).
Представьте себе, что такая полупроницаемая
перегородка делит на две части трубкуt изготовленную в форме
перевернутой буквы П. В одно колено трубки наливается раствор, а в
другое колено - вода или другой растворитель. Налив в оба колена
одинаковое количество жидкостей, мы с удивлением установим,; что при
равенстве уровней равновесия нет. Через короткое время жидкости
устанавливаются на разных уровнях. При этом повышается уровень в том
колене, где находится раствор. Вода, отделенная от раствора
полупроницаемой перегородкой, стремится разбавить раствор. Это явление и
носит название осмоса, а разность высот называется осмотическим
давлением.
В чем же причина, вызывающая осмотическое
давление? В правом колене сосуда (рис. 5.2) давление осуществляется
одной лишь водой. В левом колене полное давление складывается из
давления воды и давления растворенного вещества. Но сообщение открыто
только для воды, и равновесие при наличии полупроницаемой перегородки
устанавливается не тогда, когда давление справа равно полному давлению
слева, а тогда, когда давление чистой воды равно "водяной" доле давления
раствора. Возникающая разница полных давлений равна давлению
растворенного вещества.
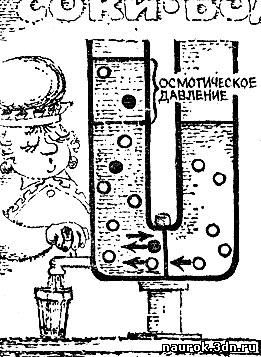
Рис. 5.2
Этот избыток давления и есть осмотическое
давление. Как показывают опыты и расчет, осмотическое давление равняется
давлению "газа", состоящего из растворенного вещества, занимающего тот
же объем. Неудивительно поэтому, что осмотическое давление измеряется,
внушительными числами. Осмотическое давление, возникающее в 1 л воды при
растворении 20 г сахара, уравновесило бы столб воды высотой в 14 м.
Рискуя возбудить у читателя неприятные
воспоминания, разберем теперь, как -связано с осмотическим давлением
слабительное действие растворов некоторых солей. Стенки кишечника
полупроницаемы для ряда растворов. Если соль через стенки кишечника не
проходит (такова глауберова соль), то в кишечнике возникает осмотическое
давление, которое отсасывает воду через ткани из организма в кишечник.
Почему очень соленая вода не утоляет жажды?
Оказывается, и в этом виновато осмотическое давление. Почки не могут
выделять мочу с осмотическим давлением, которое больше, чем давление в
тканях организма. Поэтому организм, получивший соленую морскую воду, не
только не отдает ее тканевым жидкостям, но напротив выделяет с мочой
воду, отнятую у тканей.
|  З В О Н О К НА У Р О К
З В О Н О К НА У Р О К З В О Н О К НА У Р О К
З В О Н О К НА У Р О К